國家藥監局發文,兩大抗生素修訂藥品說明書
加入日期:2019/3/11 8:47:00 查看人數: 1053 作者:admin
剛剛,國家藥監局發文,兩大抗生素修訂藥品說明書。
3月7日,國家藥監局發布公告,修訂阿莫西林(鈉)克拉維酸鉀制劑、含頭孢哌酮藥品說明書。
▍阿莫西林(鈉)克拉維酸鉀共65國產批文

據《關于修訂阿莫西林(鈉)克拉維酸鉀制劑說明書的公告》(2019年 第14號):
所有阿莫西林(鈉)克拉維酸鉀制劑生產企業均應依據《藥品注冊管理辦法》等有關規定,按照阿莫西林克拉維酸鉀口服制劑說明書修訂要求或阿莫西林鈉克拉維酸鉀注射劑說明書修訂要求,提出修訂說明書的補充申請,于2019年4月26日前報省級藥品監管部門備案。
在補充申請備案后6個月內對所有已出廠的藥品說明書及標簽予以更換。
據賽柏藍查詢,阿莫西林(鈉)克拉維酸鉀制劑共有國產藥品批文65個,涉及上藥、國藥、浙江海正等一眾藥企。

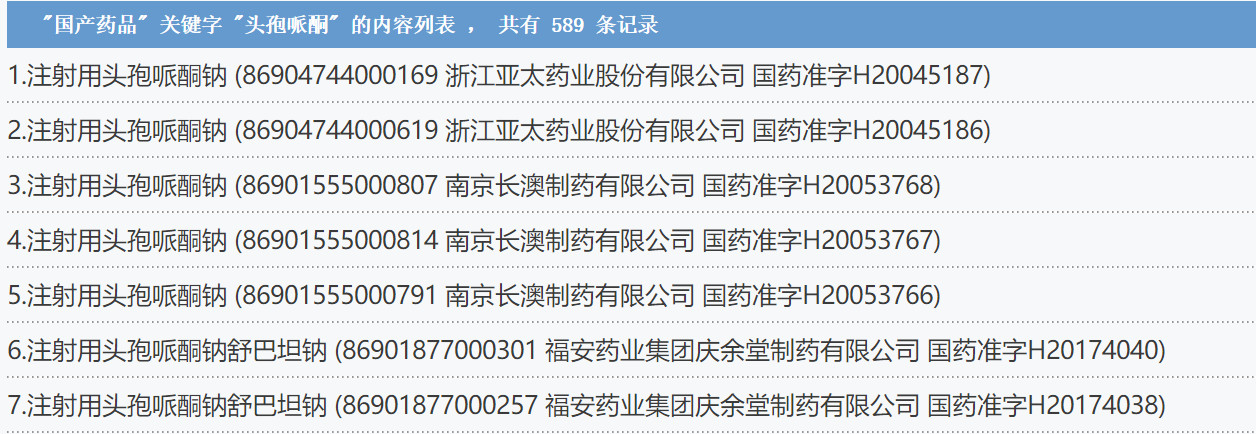
▍頭孢哌酮藥品,589國產批文
據《關于修訂含頭孢哌酮藥品說明書的公告》(2019年 第13號):

為進一步保障公眾用藥安全,國家藥品監督管理局決定對含頭孢哌酮藥品(包括注射用頭孢哌酮鈉、注射用頭孢哌酮鈉舒巴坦鈉、注射用頭孢哌酮鈉舒巴坦鈉(1∶1)、注射用頭孢哌酮鈉舒巴坦鈉(2∶1)、注射用頭孢哌酮鈉他唑巴坦鈉、注射用頭孢哌酮鈉他唑巴坦鈉(4∶1)、注射用頭孢哌酮鈉他唑巴坦鈉(8∶1)說明書【不良反應】、【禁忌】、【藥物相互作用】等項進行修訂。
所有含頭孢哌酮藥品生產企業均應依據《藥品注冊管理辦法》等有關規定,按照含頭孢哌酮藥品說明書修訂要求(見附件),提出修訂說明書的補充申請,于2019年4月26日前報省級藥品監管部門備案。
在補充申請備案后6個月內對所有已出廠的藥品說明書及標簽予以更換。
據賽柏藍查詢,含頭孢哌酮藥品共有國產藥品批文589個,石藥集團、廣州白云山、國藥集團、輔仁藥業、輝瑞制藥、哈藥三精等知名藥企均握有批文。
▍阿莫西林(鈉)克拉維酸鉀制劑不良反應、禁忌項
二、【不良反應】項應包含以下內容
皮膚及其附件損害:皮疹、瘙癢、蕁麻疹、潮紅、多形性紅斑、Stevens-Johnson綜合征、中毒性表皮壞死松解癥、剝脫性皮炎(紅皮病)和急性泛發性發疹性膿皰病。
胃腸損害:惡心、嘔吐、消化不良、腹脹、腹瀉、胃炎、口腔炎、舌炎、黑毛狀舌、偽膜性腸炎、出血性結腸炎。
免疫功能紊亂和感染:血管性水腫、皮膚與黏膜的念珠菌病、二重感染、血清病樣綜合征(蕁麻疹并伴隨關節炎、關節痛、肌痛和發熱)、哮喘、嚴重過敏樣反應、過敏性休克。
神經系統損害:頭暈、頭痛、眩暈、失眠、激動、焦慮、煩躁、行為改變、意識混亂、驚厥。
血液系統損害:白細胞減少癥(包括中性粒細胞減少癥)和血小板減少癥、血小板減少性紫癜、嗜酸性粒細胞增多、血小板增多癥、凝血酶原時間延長、粒細胞缺乏癥和溶血性貧血。
泌尿系統損害:血尿、結晶尿、間質性腎炎、急性腎損傷(包括急性腎功能衰竭、肌酐升高)。
肝膽損害:轉氨酶升高、肝炎及膽汁淤積性黃疸。
其他損害:心悸、紫紺、呼吸困難、胸悶、寒戰。
三、【禁忌】項下應包含以下內容
1. 青霉素皮試陽性反應者、對本品及其他青霉素類藥物過敏者及傳染性單核細胞增多癥患者禁用。
2. 曾經出現過阿莫西林克拉維酸鉀相關膽汁淤積或肝功能損傷的患者禁用。
▍含頭孢哌酮藥品不良反應、注意項
一、【不良反應】項下增加以下內容
血小板減少、低凝血酶原血癥、凝血障礙、出血。
二、【注意事項】項下開頭部分加入有關凝血障礙及出血的風險的警告項,具體內容如下
警告:已有Χ(藥品名稱)有關的嚴重出血包括致死情況的報告。需監測出血、血小板減少和凝血障礙跡象。如果有不明原因的持續性出血,應立即停藥。
少數患者使用本品治療后出現了導致凝血障礙的維生素K缺乏,其機制很可能與合成維生素的腸道菌群受到抑制有關,包括營養不良、吸收不良(如肺囊性纖維化患者)、酒精中毒患者和長期靜脈輸注高營養制劑在內的患者存在上述危險。有低凝血酶原血癥(伴隨出血或無出血)的報告。維生素K缺乏會引起出血傾向。應監測上述這些患者以及接受抗凝血藥治療患者的凝血酶原時間,需要時應另外補充維生素K。
出血的獨立風險因素可能包括有臨床意義出血風險增加的損傷或病癥,例如近期發生過腦梗塞(缺血性或出血性);近期有出血的活動性消化性潰瘍;自發性或獲得性止血平衡受損的患者;伴隨凝血障礙和臨床相關出血風險的肝臟疾病;系統性合并使用已知影響止血的藥物治療。
附:阿莫西林克拉維酸鉀口服制劑說明書修訂要求
一、說明書修訂總體要求
本次阿莫西林克拉維酸鉀口服制劑說明書修訂主要針對【不良反應】、【禁忌】、【注意事項】三部分內容,應遵循以下原則:如本次修訂內容較國家藥品監督管理局已批準的相關內容更嚴格、全面的,說明書應按本次修訂意見修改。國家藥品監督管理局已批準的相關內容原則上不得刪減,如原批準內容較本次修訂意見更全面或更嚴格的,應保留原批準內容。
二、【不良反應】項應包含以下內容
皮膚及其附件損害:皮疹、瘙癢、蕁麻疹、潮紅、多形性紅斑、Stevens-Johnson綜合征、中毒性表皮壞死松解癥、剝脫性皮炎(紅皮病)和急性泛發性發疹性膿皰病。
胃腸損害:惡心、嘔吐、消化不良、腹脹、腹瀉、胃炎、口腔炎、舌炎、黑毛狀舌、偽膜性腸炎、出血性結腸炎。
免疫功能紊亂和感染:血管性水腫、皮膚與黏膜的念珠菌病、二重感染、血清病樣綜合征(蕁麻疹并伴隨關節炎、關節痛、肌痛和發熱)、哮喘、嚴重過敏樣反應、過敏性休克。
神經系統損害:頭暈、頭痛、眩暈、失眠、激動、焦慮、煩躁、行為改變、意識混亂、驚厥。
血液系統損害:白細胞減少癥(包括中性粒細胞減少癥)和血小板減少癥、血小板減少性紫癜、嗜酸性粒細胞增多、血小板增多癥、凝血酶原時間延長、粒細胞缺乏癥和溶血性貧血。
泌尿系統損害:血尿、結晶尿、間質性腎炎、急性腎損傷(包括急性腎功能衰竭、肌酐升高)。
肝膽損害:轉氨酶升高、肝炎及膽汁淤積性黃疸。
其他損害:心悸、紫紺、呼吸困難、胸悶、寒戰。
三、【禁忌】項下應包含以下內容
3. 青霉素皮試陽性反應者、對本品及其他青霉素類藥物過敏者及傳染性單核細胞增多癥患者禁用。
4. 曾經出現過阿莫西林克拉維酸鉀相關膽汁淤積或肝功能損傷的患者禁用。
四、【注意事項】應包含以下內容
1.對頭孢菌素類藥物過敏者及有哮喘、變應性鼻炎、蕁麻疹等過敏性疾病史者慎用。
2.本品與其他青霉素類和頭孢菌素類藥物之間有交叉過敏性。若有過敏反應產生,則應立即停用本品,并采取相應措施。
3.本品和氨芐西林等其他青霉素類、頭孢菌素類有交叉耐藥性。
4.估算腎小球濾過率小于30ml/min時慎用,腎功能減退者應根據腎小球濾過率調整劑量或給藥間期;血液透析可影響本品中阿莫西林的血藥濃度,因此在血液透析后應加服本品1次。
5.使用高劑量的阿莫西林時,建議患者足量攝入液體并保證足夠的尿量排出,以降低發生阿莫西林結晶尿的可能性。
6.肝功能不全者慎用。
7.長期或大劑量使用本品者,應定期檢查肝、腎、造血系統功能和檢測血清鉀或鈉。
8.合并使用華法林時,為維持所需抗凝水平可能需調整口服抗凝劑的劑量。
9.該藥為時間依賴性抗生素,應嚴格按照說明書使用,多次用藥間隔時間不應少于6小時。
10.為了減少胃腸道反應,口服制劑應與餐同服。
11.本品含阿司帕坦,可代謝為苯基丙氨酸,苯丙酮尿癥患者應謹慎使用,必要時咨詢專科醫師。(僅適用于輔料中含阿司帕坦的產品說明書;阿司帕坦,別名:阿斯巴甜、甜味素、蛋白糖、甜樂、天冬甜素)
12.長期使用本品偶爾會引起非敏感性細菌的過度生長。已有使用抗生素發生偽膜性結腸炎的報告。如果患者出現持續性或嚴重腹瀉,或者出現腹部絞痛,應立即中止治療并對患者進行進一步檢查。
13.為保證治療的有效性以及避免使細菌產生耐藥性,應按醫囑規律用藥,避免遺漏或提前停藥。
14.對懷疑為伴梅毒損害之淋病患者,在使用本品前應進行暗視野檢查,并至少在4個月內,每月接受血清試驗一次。
15.對實驗室檢查指標的干擾:
(1)硫酸銅法尿糖試驗可呈假陽性,但葡萄糖酶試驗法不受影響,服用本品時,推薦應用基于葡萄糖氧化酶反應的尿糖檢測;
(2)可影響血清丙氨酸氨基轉移酶或門冬氨酸氨基轉移酶測定值。
(注:說明書其他內容如與上述修訂要求不一致的,應當一并進行修訂。)
附:含頭孢哌酮藥品說明書修訂要求
一、【不良反應】項下增加以下內容
血小板減少、低凝血酶原血癥、凝血障礙、出血。
二、【注意事項】項下開頭部分加入有關凝血障礙及出血的風險的警告項,具體內容如下
警告:已有Χ(藥品名稱)有關的嚴重出血包括致死情況的報告。需監測出血、血小板減少和凝血障礙跡象。如果有不明原因的持續性出血,應立即停藥。
少數患者使用本品治療后出現了導致凝血障礙的維生素K缺乏,其機制很可能與合成維生素的腸道菌群受到抑制有關,包括營養不良、吸收不良(如肺囊性纖維化患者)、酒精中毒患者和長期靜脈輸注高營養制劑在內的患者存在上述危險。有低凝血酶原血癥(伴隨出血或無出血)的報告。維生素K缺乏會引起出血傾向。應監測上述這些患者以及接受抗凝血藥治療患者的凝血酶原時間,需要時應另外補充維生素K。
出血的獨立風險因素可能包括有臨床意義出血風險增加的損傷或病癥,例如近期發生過腦梗塞(缺血性或出血性);近期有出血的活動性消化性潰瘍;自發性或獲得性止血平衡受損的患者;伴隨凝血障礙和臨床相關出血風險的肝臟疾病;系統性合并使用已知影響止血的藥物治療。
三、【藥物相互作用】增加以下內容
本品與能產生低凝血酶原血癥、血小板減少或胃腸道出血的藥物同時應用時,要考慮這些藥物對凝血功能以及出血危險性增加的影響。
(注:說明書其他內容如與上述修訂要求不一致的,應當一并進行修訂。)