15個大品種,進口仿制藥來了(附名單)
加入日期:2019/5/14 9:04:17 查看人數: 1441 作者:admin
近日,諾華宣布旗下山德士的子公司Lek Pharmaceuticals d.d.生產的瑞舒伐他汀通過了一致性評價,成為首個外資藥企過評的仿制藥。此次Lek的瑞舒伐他汀鈣片通過一致性評價,證實了進口仿制藥在中國也需要過評。中國仿制藥市場潛力巨大,外資藥企怎會舍得拱手相讓。數據顯示,除了瑞舒伐他汀外,目前還有14個進口仿制藥申報一致性評價。
首個通過一致性評價的進口仿制藥
圖1:Lek Pharmaceuticals d.d. 瑞舒伐他汀鈣片(受理號JYHB1840001)審評時間軸
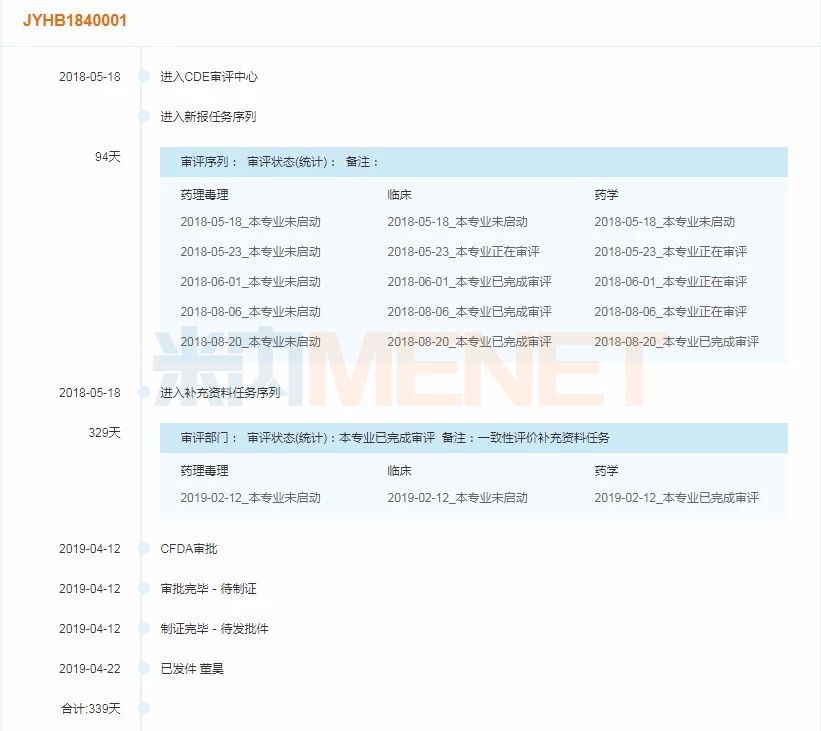
(米內網MED藥品審評數據庫2.0)
據米內網數據顯示,Lek Pharmaceuticals d.d. 的瑞舒伐他汀鈣片受理號JYHB1840001、JYHB1840002均在2018年5月18日獲得承辦,2019年4月獲批通過一致性評價,用時在330天左右。
表1:目前通過一致性評價的瑞舒伐他汀鈣片
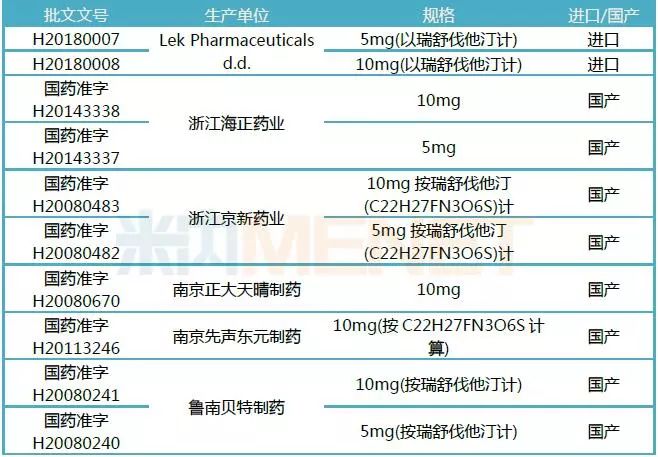
(米內網一鍵檢索)
截至2019年5月9日,瑞舒伐他汀鈣片通過或視同通過一致性評價的企業有6家,該產品在2017年中國公立醫療機構(中國城市公立醫院、縣級公立醫院、城市社區中心及鄉鎮衛生院)終端銷售額達到50.2億元。在去年年底的“4+7帶量采購”中,瑞舒伐他汀鈣片為入圍品種,浙江京新藥業以21.8元/盒(10mg*28片)中標。
京新藥業在2018年年報中提到,為保證4+7集采產品的保質保量供貨,公司內部將通過生產線產品的合理調配、生產批次的放大驗證、現場管理的精細化等管理措施,提升制劑產能,保證市場供給。帶量采購已成為接下來醫藥界的主旋律,通過一致性評價的仿制藥將成為爭奪市場的主力。
15個進口仿制藥申報一致性評價,13個仍在審
表2:目前申報一致性評價的15個進口仿制藥相關情況
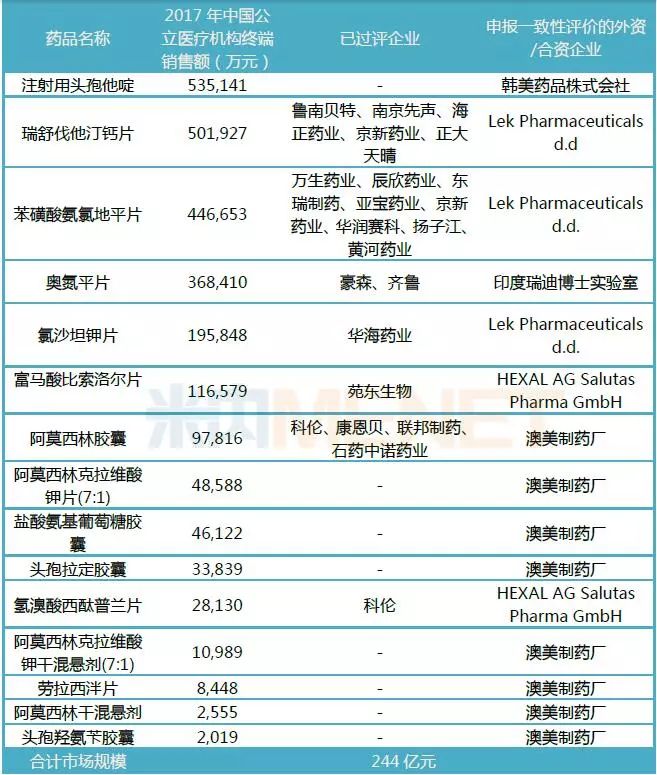
(米內網數據庫)
據米內網MED中國藥品審評數據庫2.0數據顯示,截至目前,共有15個進口仿制藥申報一致性評價,其中Lek Pharmaceuticals d.d的瑞舒伐他汀鈣片已經過評,HEXAL AG Salutas Pharma GmbH(諾華旗下公司)的氫溴酸西酞普蘭片(受理號JYHB1850001)已發件,推測尚未通過一致性評價,其余13個進口仿制藥的一致性評價補充申請均在審評審批中。
這15個進口仿制藥不乏10億以上大品種,目前除了瑞舒伐他汀鈣片、苯磺酸氨氯地平片、奧氮平片、氯沙坦鉀片、富馬酸比索洛爾片已有過評企業外,注射用頭孢他啶目前申報一致性評價的國內企業僅有齊魯制藥,最終是國內企業更勝一籌還是韓美藥品株式會社突圍成功,我們靜待結果,但目前注射劑一致性評價的進度較慢,估計還需等待一段較長的時間才能有定論。
圖2:注射用頭孢他啶一致性評價補充申請情況
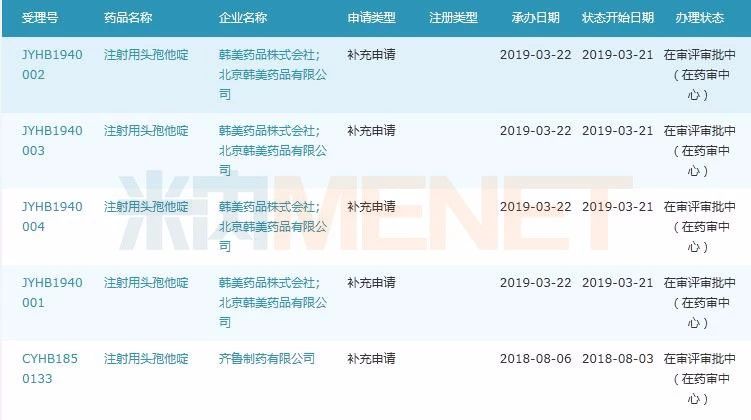
(米內網MED藥品審評數據庫2.0)
此外,上述過億規模的產品中,阿莫西林克拉維酸鉀片(7:1)、鹽酸氨基葡萄糖膠囊、頭孢拉定膠囊以及阿莫西林克拉維酸鉀干混懸劑(7:1)暫無企業通過一致性評價。
目前市場上的阿莫西林克拉維酸鉀片(7:1)有兩家企業生產,該產品申報一致性評價的企業目前僅有澳美制藥廠;市場上的阿莫西林克拉維酸鉀干混懸劑(7:1)僅有澳美制藥廠生產,同時該公司也申報了一致性評價。
圖3:鹽酸氨基葡萄糖膠囊一致性評價補充申請情況

(米內網MED藥品審評數據庫2.0)
鹽酸氨基葡萄糖膠囊為抗炎藥和抗風濕藥,2017年在中國公立醫療機構終端的銷售額為4.6億元,澳美制藥廠超過51%、北京康必得藥業占20%、浙江誠意藥業占20%、北京葡立藥業8%左右。目前除了澳美制藥廠外,浙江誠意藥業以及北京葡立藥業均有申報一致性評價,涉及的受理號均在審評審批中。
圖4:頭孢拉定膠囊一致性評價補充申請情況
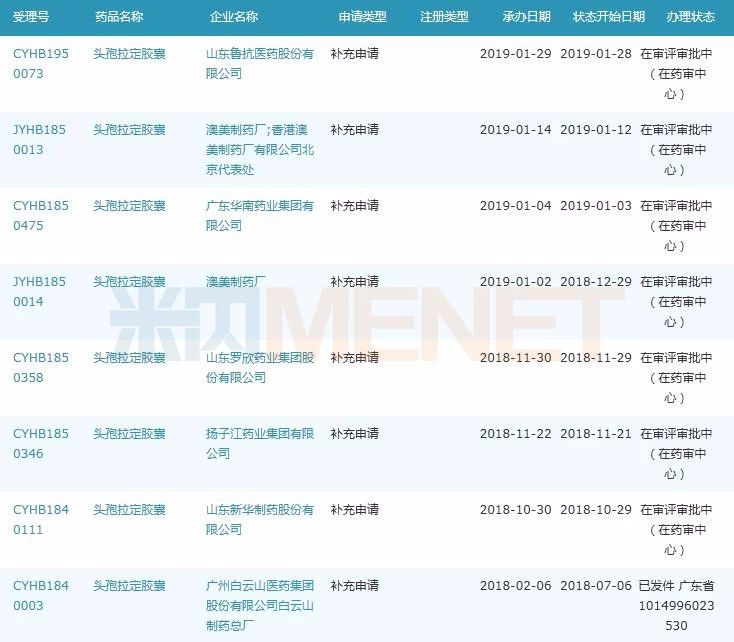
(米內網MED藥品審評數據庫2.0)
頭孢拉定膠囊為全身用抗細菌藥,2017年在中國公立醫療機構終端的銷售額為3.38億元,從市場份額來看,湖南科倫制藥占比超過20%、揚子江藥業集團、山東羅欣藥業集團、山東魯抗醫藥、施貴寶占比均超10%。目前除了澳美制藥廠外,山東魯抗醫藥、廣東華南藥業集團、山東羅欣藥業集團、揚子江藥業集團、山東新華制藥的一致性評價補充申請均在審評審批中,廣州白云山醫藥集團的受理號已發件,CDE審評建議為不批準。
這個進口仿制藥視同通過一致性評價
圖5:注射用頭孢唑林鈉/氯化鈉注射液的審批情況

(米內網MED藥品審評數據庫2.0)
圖6:注射用頭孢唑林鈉/氯化鈉注射液審評時間軸
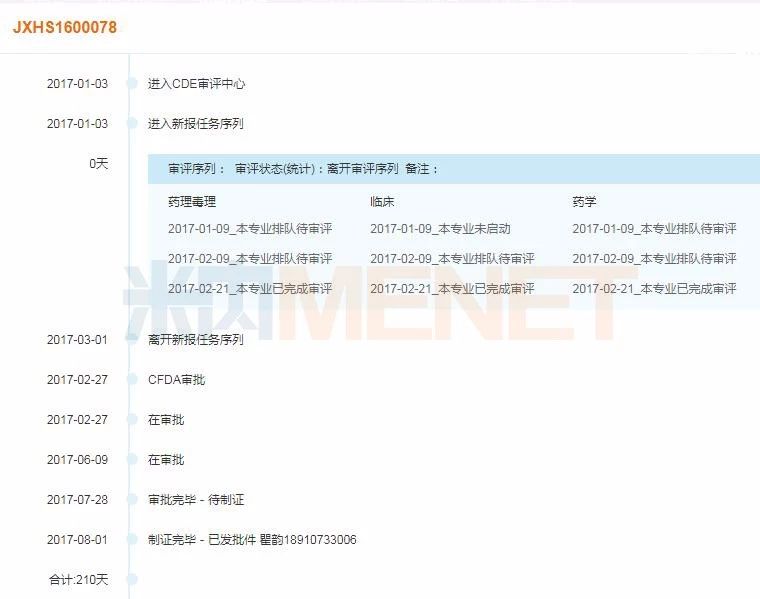
(米內網MED藥品審評數據庫2.0)
注射用頭孢唑林鈉/氯化鈉注射液為全身用抗細菌藥,大冢制藥按照5.2類注冊的進口仿制藥申報,2017年7月26日被納入中國上市藥品目錄集,收錄類別為按化學藥品新注冊分類批準的仿制藥,視同通過一致性評價。
表3:目前通過或視同通過一致性評價的注射劑
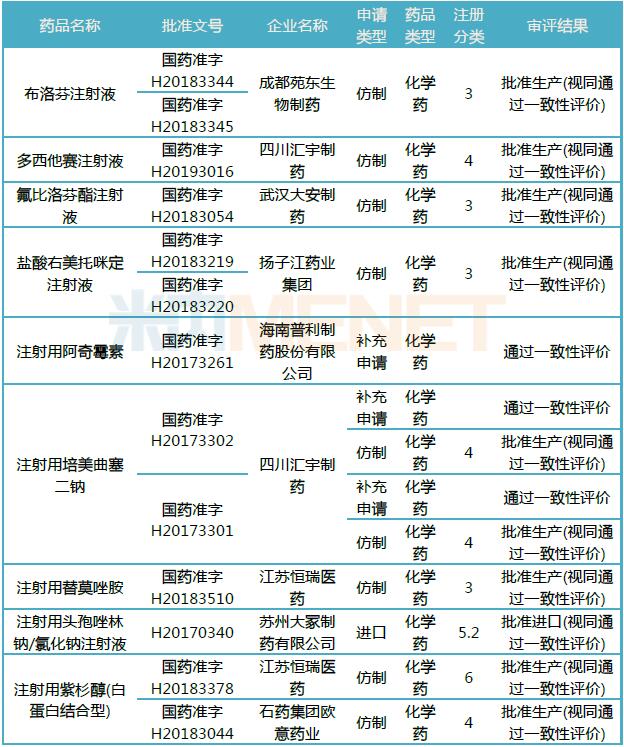
(米內網MED藥品審評數據庫2.0)
注射劑一致性評價工作進度緩慢,據米內網數據顯示,目前通過或視同通過一致性評價的注射劑有9個,其中8個是按化學藥品新注冊分類批準的仿制藥(注射用培美曲塞二鈉的4類仿制以及補充申請均獲批),可見國家層面對于注射劑的審評、監管力度也在逐漸加大。
結語
目前國內仿制藥的一致性評價工作越趨激烈,隨著帶量采購的進一步推進,中標企業也陸續獲得了實惠,行業內外對一致性評價的支持力度也逐漸加大。在我們緊盯著國內仿制藥如何挑戰原研,爭奪市場的同時,外資/合資藥企的進口仿制藥也在蠢蠢欲動,可見未來中國仿制藥市場的競爭將更加激烈,高質量的仿制藥也將逐漸成為市場主力,推動著我國醫藥產業向前發展。4+7帶量采購文件中提到,原研藥、參比制劑、通過或視同通過一致性評價的產品均有資格申報,預計這將成為后續集采品種申報企業的入場券,隨著進口仿制藥也參與到一致性評價中,后續的集采品種又將迎接著怎樣的挑戰?我們拭目以待。