PD-1市場再迎強者 價格戰悄然開打
加入日期:2019/6/6 11:06:00 查看人數: 1256 作者:admin
本就火熱的PD-1市場再迎強勢入局者。5月31日,恒瑞醫藥注射用卡瑞利珠單抗獲批,適用于至少經過二線系統化療的復發或難治性經典型霍奇金淋巴瘤患者的治療。至此,國內PD-1市場已經囊括百時美施貴寶(BMS)、默沙東、信達生物、君實生物等數家企業,百濟神州等企業的相關藥品也正處于上市申請審批階段。
北京鼎臣醫藥管理咨詢中心創始人史立臣認為,由于獲批適應證的不同,短期內PD-1進入價格競爭的幾率不大,更廣泛適應證獲批的競爭是當前的重點,但PD-1對企業的研發實力有較高要求,“投入成本很大,實力不強的企業如果進入,結果不會太好?!?
恒瑞入局PD-1市場
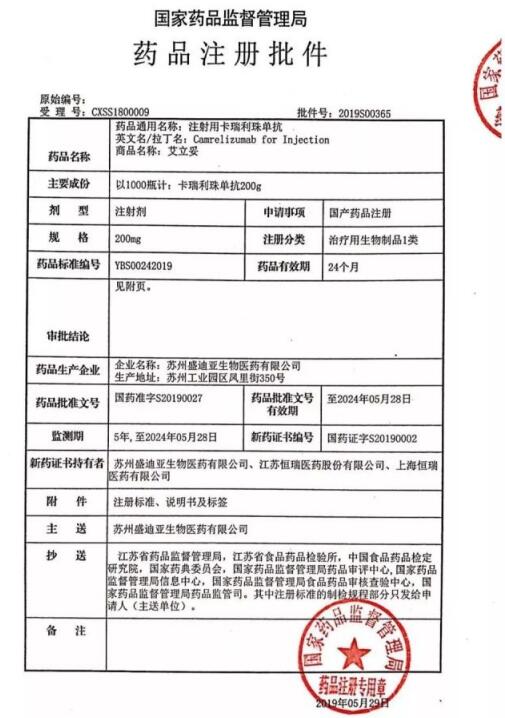
恒瑞醫藥獲批的注射用卡瑞利珠單抗是人源化抗PD-1單克隆抗體,可與人PD-1受體結合并阻斷PD-1/PD-L1通路,恢復機體的抗腫瘤免疫力,從而形成癌癥免疫治療基礎。
通常來說,T細胞能夠殺死癌細胞,久而久之,癌細胞開始“自救”,即在表面產生一種特殊的蛋白質,與T細胞結合,令T細胞產生“錯覺”,認為癌細胞“無害”,同時使得T細胞的活性降低,這種特殊的蛋白質就是PD-L1。癌細胞表面的PD-L1和T細胞表面的PD-1結合,會誘導T細胞凋亡瓦解、抑制T細胞的增殖。PD-1抑制劑和PD-L1抑制劑,通過阻斷PD-1和PD-L1的結合,使T細胞能夠正確的識別癌細胞,實現殺滅癌細胞的目的。因與傳統癌癥治療的放化療方法不同,PD-1作用于人體免疫系統,也被認為是抗腫瘤治療的“撒手锏”。
在恒瑞入局后,國內相關企業已經達到5家。其中,外資企業百時美施貴寶PD-1抗體藥物歐狄沃(簡稱O藥)與默沙東PD-1抗體藥物可瑞達(簡稱K藥)均已進入內地市場。2018年12月,首個國產PD-1單抗拓益獲批上市,2019年2月,信達生物PD-1信迪利單抗注射液正式上市。
前不久,“O藥”不良反應事件給當下正熱的PD-1市場潑了一盆冷水?!癘藥”在日本上市4年內,有11例垂體功能障礙與Opdivo存在因果關系,包括3例黑色素瘤和8例非小細胞肺癌患者,2018年11月7日,更有一例非小細胞肺癌死亡病例。百時美施貴寶隨后發布聲明稱,截至目前,在中國衛生監管部門所批準的適應證范圍內,未獲悉類似潛在不良事件。與此同時,作為罕見不良反應,腦垂體炎已在全球及中國獲批適應證產品說明書中標明,用以提醒醫療專業人士發現并及時采取相應措施。日本厚生勞動省要求小野藥品工業在其生產的抗癌藥Opdivo的使用說明中增補“重大副作用”內容。
價格戰悄然開打
PD-1被認為是抗腫瘤治療的“撒手锏”,其市場規模也不容小覷。
IMS數據庫顯示,2017年PD-1抗體全球銷售額約為88.3億美元。到了2018年,這一數字已經達141.78億美元,國內銷售額約為643.75萬美元。6月3日,東吳證券發布研報稱,預計國內PD-1市場空間將超過700億元。龐大的市場份額面前,各大藥企紛紛進軍PD-1市場,爭奪也從未停止。除了已經在國內獲批的5家企業,百濟神州等企業的相關藥品正處于上市申請審批階段。
不僅如此,已經獲批上市的企業,已經打起了價格戰。
2019年1月7日,首個國產PD-1君實生物的拓益公布了7200元/240mg(支)的定價,合30元/mg,拓益適應證為黑色素瘤,患者年治療費用18.72萬元,再加上藥物援助方案,符合贈藥條件的患者一年治療費用預估在10萬以下。兩個月之后的3月5日,信達公布,信迪利中國地區的售價為7838元/100mg,是“K”藥(帕博利珠單抗)同等規格的四折左右,亦低于同規格的“O”藥價格。信達還同時推出“3+2”積分項目,援助后,患者每個月的治療費用約為1.39萬,年治療費用為16.7萬左右。
不僅如此,“O”藥和“K”藥在國內的價格也幾乎是全球最低水平。K藥(黑色素瘤適應證)價格為17918元/100mg(支),合179元/mg,患者年費用大約在60萬元。O藥價格為40mg/10ml:4591元;100mg/10ml:9260元。不同病情和體重的患者劑量和用藥不一樣,患者年均費用在30萬左右。
在北京鼎臣醫藥管理咨詢中心創始人史立臣看來,由于獲批適應證的不同,短期內PD-1價格競爭仍有限,從長遠來看,“三五年之后,隨著各PD-1在獲批適應證上有一定的重合性,進入真正的價格競爭階段是有可能的?!?
PD-1市場的“準”競爭者并不少。2018年8月百濟神州提交了PD-1單抗的申請,獲批只是時間問題,第二梯隊方面包括正大天晴、復宏漢霖、海正藥業等十余家企業,亦有涉及30余款PD-1/PD-L1單抗在研。
適應證之爭將繼續
業界普遍認為,更廣泛適應證的獲批,已經成為PD-1市場的競爭重點。
在已經獲批的產品方面,默沙東先人一步。2019年3月29日,“K”藥獲批了新的適應證:聯合培美曲塞、順鉑一線治療EGFR和ALK陰性的轉移性非鱗狀非小細胞肺癌(NSCLC)。
除君實獲批適應證為黑色素瘤外,信達、恒瑞和百濟申請的均為霍奇金淋巴瘤。
從國內上市產品在國外獲批的適應證不難看出,適應證之爭還將繼續。以國內最早上市的歐狄沃為例,該藥已在全球超過65個國家及地區獲得批準,在美國,歐狄沃已獲批15項適應證,涉及非小細胞肺癌、黑色素瘤、腎癌、霍奇金淋巴瘤等8個瘤種,在日本、韓國和中國臺灣,歐狄沃胃癌適應證也已獲得批準。
國內企業方面,以百濟神州為例,雖然產品尚未正式獲批,但在適應證領域的爭奪已經展開。百濟神州高級副總裁汪來在接受新京報記者采訪時就表示,目前百濟神州已經在進行的PD-1注冊性臨床試驗有14項,覆蓋不同的適應證,其中有7項是全球注冊性臨床試驗。“除此以外,我們今年還會展開多項PD-1的注冊性試驗,所以到今年年底,PD-1注冊性臨床試驗預計會超過14項?!蓖魜肀硎?,百濟神州在定價時也會充分考慮患者的需求和可負擔性。
史立臣表示,“PD-1市場的競爭已經成為更廣泛適應證獲批的競爭,要增加適用人群,必然依靠適應證范圍的擴大,但這種擴大是有速度的。”
另一方面,對研發實力要求頗高的PD-1領域,對部分企業來說并不友好,單就數字而言,恒瑞醫藥在獲批產品項目中已投入研發費用約為5.04億元。史立臣指出,“按照目前的審批速度,到明年下半年應該會有幾個產品獲批上市。投入成本很大,實力不強的企業如果貿然進入,結果不會太好。因為原研藥已經進來了,國內企業也在摩拳擦掌?!?